| . |
|
||||||
|
|
| . |
|
||||||
| Les Virus |
|
|
On a d'abord désigné
sous le terme de virus tous les agents infectieux susceptibles de
provoquer l'apparition d'un ensemble morbide quand ils sont introduits
dans un organisme vivant. Le terme s'est ensuite appliqué à
tout micro-organisme infectieux (y compris, par exemple, les bactéries).
Aujourd'hui on n'appelle virus que certaines entités microscopiques,
dont la place dans le monde vivant est très singulière, voire
problématique. Bien plus petits et génétiquement plus
simples (un seul type d'acide nucléique)
que les bactéries, les virus n'ont pas de vie indépendante
de celles des organismes qu'ils parasitent. Ils apparaissent
ainsi comme des entités parasitaires non-cellulaires qui ne peuvent
être classées dans aucun règne. Ils peuvent infecter
des organismes aussi divers que les archées, les bactéries
procaryotes, les eucaryotes tels que les champignons,
les plantes et les animaux,
et provoquer chez leurs hôtes de très nombreuses maladies,
certaines mortelles. Il existe même des virus de virus, appelés
virus satellites. En fait, les virus appartiennent à un monde
intermédiaire entre celui des organismes vivants et celui des entités
non-vivantes.
Les êtres vivants proprement dits grandissent, métabolisent et se reproduisent. En revanche, les virus, qui ne sont pas cellulaires, n'ont pas de métabolisme; ils ne peuvent pas non plus se développer et se reproduire par division cellulaire. Les virus peuvent seulement se copier ou se répliquer. Pour cela, ils dépendent entièrement des ressources dérivées de leurs cellules hôtes pour produire une descendance (des virus sont assemblés sous leur forme mature). Les
virus diffèrent beaucoup les uns des autres : leur structure, leurs
modes de réplication et les hôtes qu'ils infectent sont très
variables. Comment expliquer cette diversité? Alors que la plupart
de la diversité biologique peut être comprise à travers
l'histoire de l'évolution (comment les espèces se sont adaptées
aux conditions environnementales changeantes et comment les différentes
espèces sont liées les unes aux autres par une descendance
commune), les origines et l'évolution des virus reste inconnue.
Les virus n'ont pas laissé de trace fossile,
aussi personne ne sait exactement quand ni comment les virus ont évolué
et à partir de quelle source ancestrale. Certains virologues soutiennent
que les virus actuels sont une mosaïque d'acides nucléiques
extraits de diverses sources le long de leurs chemins évolutifs
respectifs.
Crédit : F. A. Murphy / Ecole de médecine vétérinaire de l'université de Californie, Davis. Découverte et détection des virus. Si la notion de la contagion des maladies a été entrevue de tout temps, la cause même est restée longtemps ignorée. Dans le Dictionnaire de Littré « De même qu'il n'y a pas de chaleur séparable des corps, mais des variations de température, des états chauds et froids de la matière relativement, de même, il n'y a pas de virus en tant qu'espèce de corps ou principes pondérables ou isolables. Les virus, pas plus que les miasmes, ne sont non plus des éléments figurés, comme le supposent encore quelques médecins ou micrographes; ce sont des états virulents (totius substantiae) des corps organisés » (Dict. Littré et Robin, édit. 1878).Grâce aux travaux de Pasteur Le pas décisif a été accompli avec le développement d'un filtre en porcelaine - le filtre Chamberland-Pasteur - qui pouvait éliminer toutes les bactéries visibles au microscope de tout échantillon liquide. En 1886, Adolph Meyer a démontré qu'une maladie des plants de tabac (maladie de la mosaïque du tabac) pouvait être transférée d'une plante malade à une plante saine via des extraits de plantes liquides. En 1892, Dmitri Ivanowski a montré que cette maladie pouvait être transmise de cette manière même après que le filtre Chamberland-Pasteur ait retiré toutes les bactéries viables de l'extrait. Il a fallu encore de nombreuses années avant qu'il ne soit prouvé que ces agents infectieux « filtrables » n'étaient pas simplement de très petites bactéries et constituaient un nouveau type de minuscules particules pathogènes. A partir de là, on a réservé le nom de virus aux agents infectieux non bactériens. L'étape décisive, qui permettra à la virologie de prendre véritablement son essor, est franchie en 1949, quand John Enders, Thomas Weller et Frederick Robbins parviennent pour la première fois à cultiver in vitro un virus (celui de la polio). Les aspects physiques et chimiques des virus peuvent désormais être étudiés en détail grâce à la disponibilité des grandes quantités de virus ainsi produits. En 1954, André Lwoff (auteur en 1964 d'une classification des virus) donne la définition du virion ( = particule virale responsables de l'infection de cellule à cellule) qui est aujourd'hui encore en vigueur : le virion possède un seul acide nucléique à partir duquel il se reproduit; il ne peut ni croître ni se diviser; il ne possède aucune information concernant les enzymes du métabolisme producteur d'énergie; la multiplication des virions implique l'utilisation des ressources fournies par la cellule hôte (par leurs ribosomes notamment). Le virion est donc un parasite absolu. On a distingué plus tard les virus de deux autres agents infectieux répondant (entièrement pour le premier et partiellement pour le second) à cette définition : les viroïdes (ARN non-codant), qui peuvent encore être rangés parmi les virus, et les prions (protéines), qui sont les premiers agents pathogènes connus ne reposant pas sur des gènes formés d'un acide nucléique. La découverte des viroïdes date du début des années 1970 (Theodor Otto Diener). Les prions dont le rôle d'agent infectieux est parfois encore contesté aujourd'hui ont été découverts vers 1980 (Stanley Prusiner). Un
virus c'est tout petit.
À l'exception des grands virions, comme le virus de la variole et d'autres grands virus à ADN, les virus ne peuvent pas être vus au microscope optique. Ce n'est que lors du développement du microscope électronique à la fin des années 1930 que les scientifiques ont eu leur premier bon aperçu de la structure du virus de la mosaïque du tabac et d'autres virus. La structure de surface
des virions peut être observée à la fois par microscopie
électronique à balayage et à transmission, tandis
que les structures internes du virus ne peuvent être observées
que sur les images d'un microscope électronique à transmission.
L'utilisation de la microscopie électronique et d'autres technologies
a permis la découverte de nombreux virus de tous les types d'organismes
vivants.
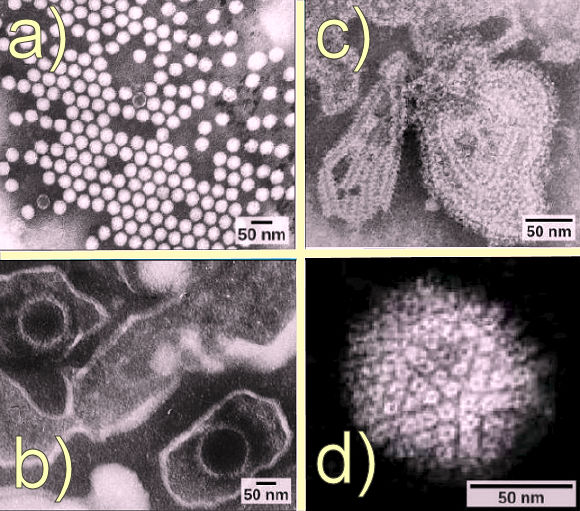
Évolution virale, morphologie et classificationEvolution des virus.Bien que les biologistes possèdent une quantité importante de connaissances sur la façon dont les virus actuels subissent des mutations et s'adaptent, on en sait beaucoup moins, on l'a dit, sur l'origine des virus. Lorsqu'ils explorent l'histoire évolutive de la plupart des organismes, les scientifiques peuvent examiner les archives fossiles et les preuves historiques similaires. Cependant, à notre connaissance, les virus ne se fossilisent pas. Les virologues doivent donc extrapoler à partir d'enquêtes sur l'évolution des virus d'aujourd'hui et en utilisant des informations biochimiques et génétiques pour créer des histoires spéculatives des virus. La plupart des chercheurs conviennent que les virus n'ont pas un seul ancêtre commun, et qu'il n'y a pas une seule hypothèse raisonnable sur les origines des virus. Il existe actuellement plusieurs scénarios évolutifs qui peuvent expliquer l'origine des virus. • L'une de ces hypothèses, la « dévolution » ou hypothèse régressive, suggère que les virus ont évolué à partir de cellules indépendantes ou de parasites procaryotes intracellulaires. Cependant, de nombreuses composantes de la façon dont ce processus aurait pu se produire restent inconnues.Dans tous les cas, les virus continuent probablement d'évoluer avec les cellules qu'ils utilisent comme hôtes. À mesure que la technologie progresse, les scientifiques pourraient développer et affiner des hypothèses supplémentaires pour expliquer les origines des virus. Un domaine émergent, appelé systématique moléculaire des virus, s'est donné cet objectif en comparant le matériel génétique séquencé. Les chercheurs de cette branche espèrent mieux comprendre l'origine des virus : une découverte qui pourrait conduire à des avancées dans les traitements des maladies dont ces redoutables entités sont responsables. Morphologie virale.
Un virion est d'abord constitué d'un noyau d'acide nucléique. Celui-ci, souvent étroitement associé à des protéines internes, est entouré d'un revêtement protéique externe rigide, la capside. Ces éléments forment ce qu'on appelle la nucléocapside. La capside peut être nue, mais parfois elle est entourée d'une enveloppe externe (le péplos) constituée de membranes protéiques et phospholipidiques dérivées de la cellule hôte. Les virus peuvent également contenir des protéines supplémentaires, telles que des enzymes, à l'intérieur de la capside ou attachées au génome viral. La différence
la plus évidente entre les membres de différentes familles
virales est la grande diversité de leur morphologie. Une caractéristique
intéressante de la complexité virale est que la complexité
de l'hôte n'est pas nécessairement en corrélation avec
la complexité du virion. Ainsi, certaines des structures de virions
les plus complexes se trouvent-elles dans les bactériophages, les
virus qui infectent les bactéries, c'est-àdire
les organismes vivants les plus simples.
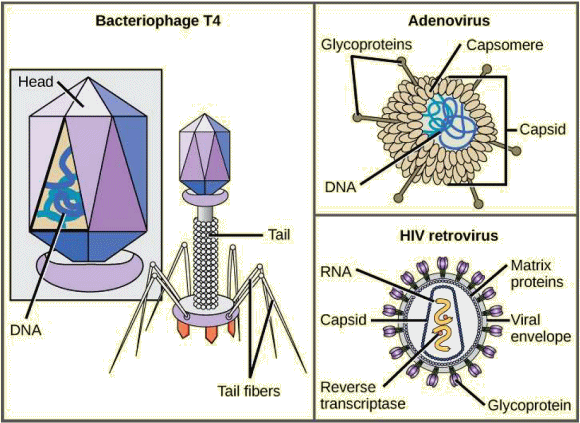
Les
capsides.
En général, les capsides des virus peuvent donc être rangées dans trois classes : hélicoïdales, icosaédriques et complexes. • Les capsides dites à symétrie hélicoïdale sont longues et cylindriques. De nombreux virus des végétaux sont hélicoïdaux, par exemple le virus de la mosaïque du tabac.De nombreux virus utilisent un certain type de glycoprotéine (= protéine associée à un glucide) pour se fixer à leurs cellules hôtes via des molécules présentes sur la cellule appelées récepteurs viraux. Pour ces virus, la fixation est nécessaire afin de permettre une pénétration ultérieure dans la membrane cellulaire; ce n'est qu'après la pénétration que le virus peut achever sa réplication à l'intérieur de la cellule. Les récepteurs utilisés par les virus sont des molécules qui se trouvent normalement à la surface des cellules et qui ont leurs propres fonctions physiologiques. Il semble que les virus aient simplement évolué pour utiliser ces molécules pour leur propre réplication. Ainsi, le VIH utilise-t-il la molécule CD4 des lymphocytes T (globules blancs) comme l'un de ses récepteurs. CD4 est un type de molécule appelé molécule d'adhésion cellulaire, qui agit pour maintenir différents types de cellules immunitaires à proximité les unes des autres lors de la génération d'une réponse immunitaire des lymphocytes T. Les
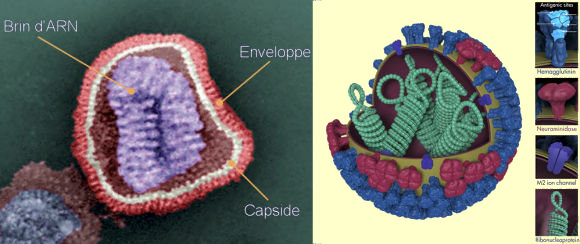
enveloppes (péplos).
L'enveloppe se forme
au moment de la traversée de la membrane cellulaire, lorsque le
virus nouvellement assemblé quitte la cellule hôte. Cette
enveloppe comprend des éléments d'origine virale et d'autres
qui sont pris à la cellule. Elle est constituée, comme la
capside, d'un assemblage d'unités de structures, appelées
ici pléplomères. Les propriétés antigéniques
de surface de l'enveloppe déterminent la reconnaissance des cellules
sensibles à l'infection et jouent aussi un rôle dans la maturation
et la libération du virus.
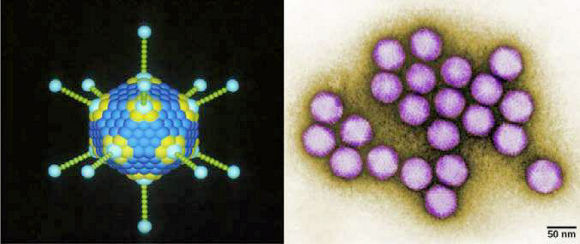
La présence de lipides dans l'enveloppe rend les virus enveloppés particulièrement sensibles aux solvants organiques (l'éther, par exemple). De façon générale, en raison de la fragilité de l'enveloppe, les virus enveloppés résistent plus mal que les virus non-enveloppés aux changements de température, de pH et à certains désinfectants. Parmi les virus
non-enveloppés ( = à nucléocapside nue), on peut citer
ceux qui causent la polio (Poliovirus), les verrues plantaires (Papillomavirus)
et l'hépatite A ( Hepatovirus), le virus de la mosaïque
du tabac (Tomabovirus), ou encore l'Adénovirus (image ci-dessous).
Types
d'acide nucléique.
Alors que la plupart des virus contiennent un seul acide nucléique, d'autres ont des génomes divisés en plusieurs segments (fragments subgénomiques). Le génome porté par l'ARN du virus de la grippe (Myxovirus influenza), par exemple, est dans ce cas (normalement 9 segments). Cette segmentation contribue à sa variabilité et à son évolution continue, et explique pourquoi il est difficile de développer un vaccin contre la grippe. • Les virus à ADN ne contiennent, comme matériel génétique, que de l'acide déxyribonucléique. Celui-ci est généralement bicaténaire (à double brin), similaire en cela à la double hélice décrite par Watson et Crick. Il est rarement circulaire (cas des Papovirus) et donc la plupart du temps linéaire. Une circularisation de la molécule initialement linéaire peut cependant avoir lieu après l'infection : ce changement de morphologie s'avérant nécessaire ici pour que l'ADN viral s'intègre dans le chromosome cellulaire.- 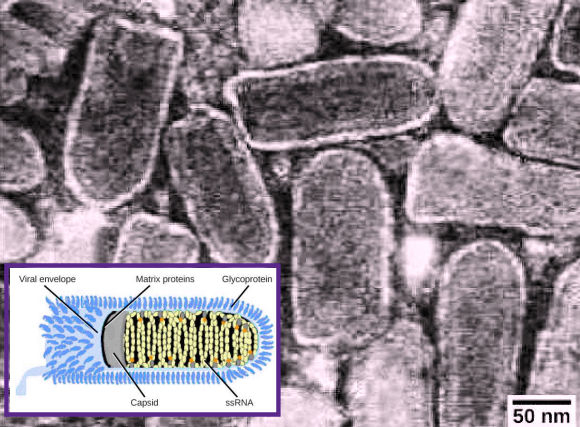
Virus de la rage (Lyssavirus). - C'est un virus enveloppé, à ARN monocaténaire et à capside hélicoïdale. Comment sont classés
les virus.
Les biologistes ont cependant proposé plusieurs systèmes de classification. Les virus ont été initialement regroupés selon leur morphologie. Plus tard, les groupes de virus ont été classés selon le type d'acide nucléique qu'ils contenaient, ADN ou ARN, et selon que leur acide nucléique était simple ou double. La méthode de classification la plus couramment utilisée aujourd'hui est appelée le système de classification de Baltimore, du nom du biologiste David Baltimore, qui l'a développé au début des années 1970. Celui-ci est basée sur la façon dont l'ARN messager (ARNm) est généré dans chaque type particulier de virus. Les
anciens systèmes de classification.
La
classification de Baltimore.
Infections virales et hôtesLes virus sont des parasites intracellulaires obligatoires.Un virus doit d'abord reconnaître et s'attacher à une cellule vivante spécifique avant d'y pénétrer. Après pénétration, le virus envahisseur doit copier son génome et fabriquer ses propres protéines. Enfin, les virions descendants doivent s'échapper de la cellule hôte pour pouvoir infecter d'autres cellules. Bien que l'on connaisse des virus capables d'infecter en même temps des organismes appartenant à plusieurs phylums, voire à plusieurs règnes, le plus souvent, les virus ne peuvent infecter que certaines espèces d'hôtes et uniquement certaines cellules de cet hôte. Le virus de l'hépatite B n'infecte que les Humains, tandis que celui de la poliomyélite peut infecter tous les Primates. Tel virus peut aussi infecter plusieurs espèces, en provoquant des maladies très différentes dans l'une au l'autre espèce ou bien peut provoquer chez l'une une maladie sérieuse, tout en ne causant chez une autre aucune maladie. De même, un virus donné, au sein d'une espèce particulière peut être à l'origine de la mort de certains individus, alors que d'autres individus infectés ne manifestent aucun symptôme. Les cellules hôtes
spécifiques qu'un virus doit occuper et utiliser pour se répliquer
sont dites permissives. Dans la plupart des cas, la base moléculaire
de cette spécificité est dûe à une molécule
particulière à la surface de la cellule hôte et connue
sous le nom de récepteur viral. Un récepteur viral
spécifique est nécessaire pour que le virus se fixe. Les
différences de métabolisme et de réponses immunitaires
des cellules hôtes sont aussi un facteur probable intervenant
dans la détermination des cellules qu'un virus peut cibler pour
sa réplication.
Étapes
des infections virales.
Ces changements, appelés effets cytopathiques, peuvent modifier les fonctions cellulaires ou même détruire la cellule. Certaines cellules infectées, telles que celles infectées par le virus du rhume commun (Rhinovirus), meurent par lyse ( = éclatement) ou apoptose ( = mort cellulaire programmée ou «-suicide cellulaire-»). Cette mort libère en une seule fois tous les virions engendrés. Les symptômes des maladies virales résultent à la fois de ces dommages cellulaires causés par le virus et de la réponse immunitaire au virus, c'est-à-dire de la réaction de l'organisme qui tente de contrôler et d'éliminer le virus. De nombreux virus animaux, tels que le VIH (virus de l'immunodéficence humaine ou sida), quittent les cellules infectées du système immunitaire par un processus appelé bourgeonnement, dans lequel les virions quittent la cellule individuellement. Pendant le processus de bourgeonnement, la cellule ne subit pas de lyse et n'est pas immédiatement tuée. Les dommages que cause le virus aux cellules qu'il infecte peuvent empêcher le fonctionnement normal de celle-ci, même si elles restent en vie pendant un certain temps. Le cycle de réplication
des virus, lors d'une infection virale, suit la plupart du temps
des étapes similaires : fixation, pénétration, réplication,
assemblage et libération.
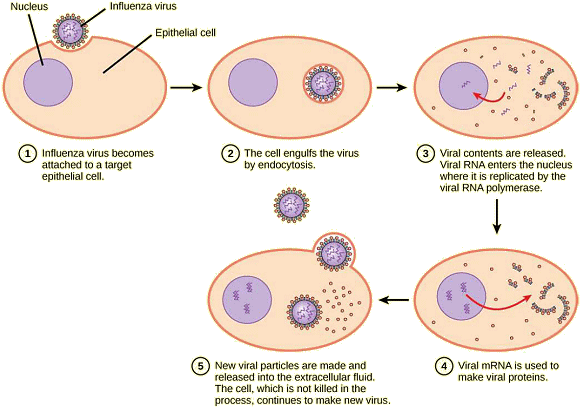
Fixation.
Pénétration.
• Certains virus peuvent pénétrer dans une cellule hôte sans leur capside : l'acide nucléique des bactériophages pénètre ainsi dans la cellule hôte en laissant la capside à l'extérieur de la cellule.Une fois à l'intérieur de la cellule, la capside virale se dégrade, puis l'acide nucléique viral est libéré et devient disponible pour la réplication et la transcription. Réplication
et assemblage.
• Les virus à ADN utilisent généralement des protéines et des enzymes des cellules hôtes pour répliquer l'ADN viral et transcrire l'ARNm viral, qui est ensuite utilisé pour piloter à la synthèse des protéines virales.Ce schéma connaît des exceptions. Si une cellule hôte ne fournit pas les enzymes nécessaires à la réplication virale, les gènes viraux doivent fournir les informations nécessaires pour permettre la synthèse des protéines manquantes. Les rétrovirus, tels que le VIH (groupe VI du système de classification de Baltimore), ont un génome d'ARN qui doit être transcrit en ADN de manière inverse, avant d'être incorporé dans le génome de la cellule hôte. Pour convertir l'ARN en ADN, les rétrovirus doivent contenir des gènes codants pour l'enzyme transcriptase inverse spécifique au virus qui transcrit une matrice d'ARN en ADN. La transcription inverse ne se produit jamais dans les cellules hôtes non infectées - l'enzyme transcriptase inverse est uniquement dérivée de l'expression de gènes viraux dans les cellules hôtes infectées. Libération. La dernière étape de la réplication virale est la libération des nouveaux virions produits dans l'organisme hôte; ils deviennent alors capables d'infecter les cellules adjacentes et de répéter le cycle de réplication. Comme on l'a vu, certains virus sont libérés lorsque la cellule hôte meurt et d'autres virus peuvent quitter les cellules infectées en bourgeonnant à travers la membrane sans tuer directement la cellule. Différents
hôtes et leurs virus.
Voyons maintenant les caractéristiques de l'infection virale des cellules procaryotes (bactéries) et eucaryotes (plantes et animaux). Bactériophages.
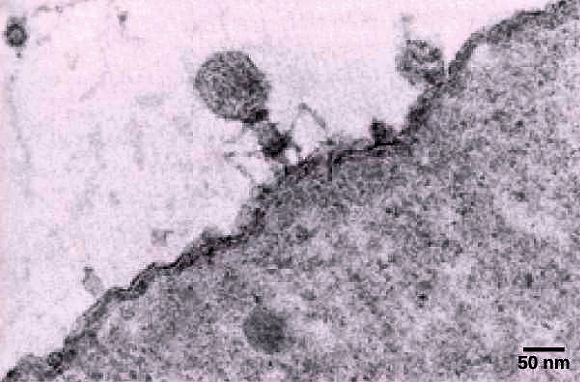
Bactériophage T fixé sur une bactérie Escherichia coli. A partir du moment où l'infection d'une cellule par un bactériophage entraîne la production de nouveaux virions, l'infection est dite productive. Deux situations peuvent alors s'observer. • Le génome viral utilise les ressources de la cellule hôte pour se multiplier. Chaque nouvel acide nucléique viral ainsi produit s'entoure d'une capsule protéique pour former un nouveau virion; la synthèse des protéines étant codée par l'ADN viral, mais la matière première (acides aminés) et énergie (ATP) provenant de la cellule hôte. Les virions, une fois assemblés, sont libérés en faisant éclater la cellule et peuvent aller infecter d'autres bactéries. On dit dans ce cas que le virus se réplique via un cycle lytique. Le bactériophage T4, qui infecte Escherichia coli, fournit un exemple de virus lytique ou virulent. 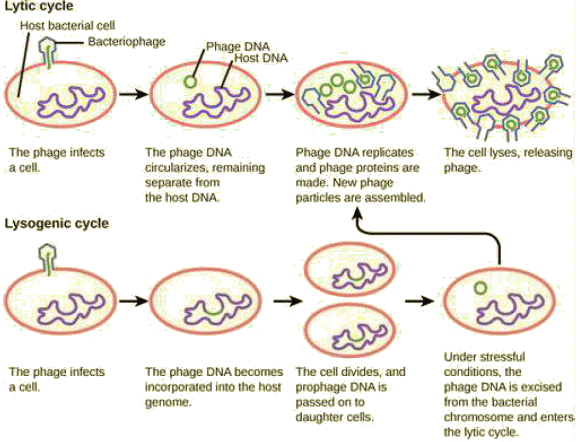
N. B. : Un processus analogue au cycle lysogène s'observe aussi avec le virus des plantes et des animaux. Ces virus peuvent parfois causer des infections où ils ne produisent pas de virions pendant de longues périodes. On parle alors de latence (V. plus pas)..C'est ce qui se produit, par exemple, avec le virus de l'herpès simplex, qui est la cause de l'herpès oral et génital chez l'Humain. Pendant la période de latence, ce virus peut exister dans le tissu nerveux durant de longues durées sans produire de nouveaux virions, puis quitter périodiquement la latence pour provoquer des lésions de la peau, qui correspondent à la phase de réplication du virus. Les
virus des plantes.
La plupart des virus végétaux, à l'instar du virus de la mosaïque du tabac, ont des génomes d'ARN monocaténaire et à polarité positive (groupe IV de la classification de Baltimore). Cependant, il existe également des virus végétaux dans la plupart des autres catégories de virus. Les virus des végétaux
peuvent être transmis d'une plante à l'autre par divers vecteurs
: par contact avec la sève d'une plante infectée, par des
organismes vivants tels que les insectes et
les nématodes, et par le pollen.
Contrairement aux bactériophages, les virus végétaux
n'ont pas de mécanismes actifs pour délivrer le génome
viral à travers la paroi cellulaire protectrice. Aussi, pour qu'un
virus végétal pénètre dans une nouvelle plante
hôte, un certain type de dommage mécanique doit se produire.
Ces dommages sont souvent causés par les intempéries, les
insectes, les animaux herbivores, le feu ou les
activités humaines comme l'agriculture ou l'aménagement paysager.
Virus de la mosaïque du tabac (Tobamovirus). Il s'agit d'un virus à capside hélicoïdale très allongée (longueur 300 nm, diamètre 15 à 20 nm). Il renferme une molécule d'ARN composée de 6000 nucléotides environ. Crédit : USDA ARS. Le passage du virus d'une cellule à l'autre au sein d'une plante peut être facilité par la modification virale des plasmodesmes (filaments cytoplasmiques qui passent d'une cellule végétale à la suivante). La progéniture végétale peut aussi hériter des maladies virales des plantes mères. Le transfert d'un virus d'une plante à une autre est appelé transmission horizontale, tandis que l'hérédité d'un virus d'un parent est appelée transmission verticale. Les symptômes
des maladies virales varient en fonction du virus et de son hôte.
Un symptôme courant est l'hyperplasie, c'est-à-dire
la prolifération anormale de cellules qui provoque l'apparition
de tumeurs végétales appelées galles. D'autres
virus provoquent une hypoplasie ou une diminution de la croissance
cellulaire dans les feuilles des plantes, provoquant
l'apparition de fines zones jaunes. D'autres virus encore affectent la
plante en tuant directement les cellules végétales (nécrose
cellulaire). Parmi les autres symptômes dus à l'infection
de virus de végétaux, on peut signaler des feuilles malformées,
des stries noires sur les tiges des plantes, des altération de la
croissance des tiges, des feuilles ou des fruits,
ou encore des taches annulaires, qui sont des zones de décoloration
circulaires ou linéaires observables sur une feuille.

Feuilles d'orchidées infectées par le virus de la mosaïque du tabac. (Image : USDA Forest Service / North Carolina State University). Les virus des plantes peuvent gravement perturber la croissance et le développement des cultures, affectant considérablement notre approvisionnement alimentaire. Ils sont responsables parfois de la mauvaise qualité et de la faible quantité des récoltes à l'échelle mondiale et peuvent entraîner d'énormes pertes économiques. Parmi les virus qui infectent les plantes alimentaires, on peut mentionner : le virus de la flétrissure de la tomate, le virus de la mosaïque commune du haricot et le virus de la mosaïque du concombre. Dans les plantes d'ornement, deux des virus les plus courants sont celui qui occasionne la tache en anneau de la pivoine et le virus de la mosaïque du rosier. Les symptômes du virus de la mosaïque commune du haricot se traduisent par une baisse de la production de haricots, des rabougrissements et des plants improductifs. Dans le cas de la rose ornementale, la maladie de la mosaïque du rosier provoque des lignes jaunes ondulées et des taches colorées sur les feuilles de la plante. Les
virus des animaux.
Les virus des animaux non-enveloppés ou nus peuvent pénétrer dans les cellules de deux manières différentes : • A partir du moment où une protéine de la capside virale se lie à son récepteur sur la cellule hôte, le virus peut être introduit à l'intérieur de la cellule via une vésicule au cours du processus cellulaire normal d'endocytose dont le récepteur est le médiateur. On parle ici d'endocytose médiée par les récepteurs.Les virus enveloppés ont également deux façons d'entrer dans les cellules après s'être liés à leurs récepteurs : • L'endocytose médiée par les récepteurs, similaire à celle que l'on vient de voir pour certains virus non-enveloppés. Elle concerne de nombreux virus enveloppés, qui pénètrent ainsi dans les cellules.Après avoir fabriqué leurs protéines et copié leurs génomes, les virus des animaux achèvent l'assemblage de nouveaux virions et quittent la cellule. Comme nous l'avons déjà mentionné à propos du virus de la grippe, les virus animaux enveloppés peuvent s'extraire de la membrane cellulaire par bourgeonnement au fur et à mesure qu'ils s'assemblent à partir du matériau mis à disposition par la membrane plasmique de la cellule. Il se peut aussi, comme on l'observe avec le rhinovirus, que les descendants viraux non-enveloppés s'accumulent dans les cellules infectées jusqu'à ce qu'il y ait un signal de lyse ou d'apoptose; dans ce cas, tous les virions sont libérés ensemble. Comme on va le voir, les virus des animaux sont associés à diverses maladies humaines. Certaines d'entre elles (le rhume, la grippe) suivent le schéma classique de la maladie aiguë : les symptômes s'aggravent pendant une courte période, suivie par l'élimination du virus du corps par le système immunitaire, puis par une récupération de l'infection. D'autres virus, à l'instar de celui qui cause l'hépatite C, provoquent des infections chroniques à long terme, tandis que d'autres encore, comme c'est le cas du virus de l'herpès simplex, ne provoquent que des symptômes intermittents. D'autres virus enfin, peuvent provoquer une maladie chez certains individus et ne donner lieu à aucun symptôme chez d'autres, alors même qu'on est bien en présence d'un infection productive. C'est le cas, dans une proportion encore mal déterminée, du coronavirus responsable du covid-19 ou encore, plus clairement, des herpèsvirus humains 6 et 7, responsables chez certains patients de la roséole, une maladie infantile mineure, et dont l'infection chez d'autres ne donne lieu à aucun symptôme. On dit alors que ces patients ont une infection asymptomatique. Dans les infections
à l'hépatite C, le virus se développe et se reproduit
dans les cellules hépatiques, causant des lésions hépatiques
mineures. Les dommages sont si faibles que les personnes infectées
ignorent souvent qu'elles sont infectées et de nombreuses infections
ne sont détectées que par des analyses de sang de routine
sur des patients présentant des facteurs de risque (consommation
de drogues par voie intraveineuse).
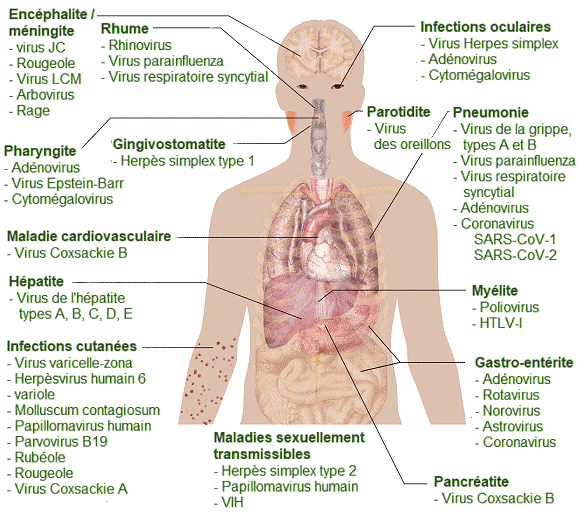
Aperçu
des infections virales chez ls Humains. - Les virus peuvent provoquer
des dizaines
Il convient ici de remarquer que de nombreux symptômes des maladies virales sont causés par les réponses immunitaires de l'organisme. Il s'ensuit qu'un manque de symptômes signifie alors une faible réponse immunitaire au virus. Cela permet au virus d'échapper à l'élimination par le système immunitaire et de persister chez les individus pendant des années, tout en produisant des virions descendants en faible quantité. On a alors affaire à une maladie virale chronique. Une infection chronique du foie par le virus de l'hépatite C augmente les chances de développer un cancer du foie, parfois jusqu'à 30 ans après l'infection initiale. Les virus infectant les animaux sur le même mode que le virus de l'hépatite C sont appelés virus oncogènes, c'est-à-dire qu'ils ont la capacité de provoquer un cancer. Ces virus interfèrent avec la régulation normale du cycle cellulaire hôte soit en introduisant des gènes qui stimulent la croissance cellulaire non régulée (oncogènes), soit en interférant avec l'expression des gènes qui inhibent la croissance cellulaire. Les virus oncogènes peuvent être des virus à ADN ou à ARN. Parmi les cancers connus pour être associés à des infections virales, on citera le cancer du col de l'utérus, causé par le papillomavirus humain (HPV) , le cancer du foie causé par le virus de l'hépatite B, la leucémie à cellules T, ainsi que plusieurs types de lymphomes. On l'a vu, le virus de l'herpès simplex peut rester dans un état de latence dans le tissu nerveux pendant des mois, voire des années. Comme le virus «-se cache-» dans les tissus et produit peu ou pas de protéines virales, il n'y a rien contre quoi la réponse immunitaire puisse agir et l'immunité au virus diminue lentement. Dans certaines conditions (divers types de stress physique et psychologique, par exemple), le virus de l'herpès simplex latent peut être réactivé et subir un cycle de réplication lytique dans la peau, provoquant les lésions associées à la maladie (apparitions de boutons de fièvre et d'herpès génital). Une fois que les virions sont produits dans les cellules de la peau et que les protéines virales sont synthétisées, la réponse immunitaire est à nouveau stimulée et résout les lésions cutanées en quelques jours ou semaines en détruisant les virus qui sont dans la peau. Mais, les virus restant dans l'organisme à vie, ce même cycle réplicatif, pourra encore se produire par intermittence. Les infections latentes sont également courantes avec d'autres herpèsvirus, aisni en est-il du virus qui cause la varicelle-zona (herpès humain 3). Dans ce cas, après avoir infecté certains individus par la varicelle dans l'enfance, le virus peut rester latent pendant de nombreuses années et se réactiver chez l'adulte pour provoquer une affection douloureuse connue sous le nom de zona. Prévention et traitement des infections viralesLes maladies causées par les virus peuvent être traitées par des médicaments antiviraux ou par des vaccins. Il existe cependant des virus, comme le VIH, qui sont capables d'éviter la réponse immunitaire, ce qui les rend rétifs aux vaccins, ou encore de muter au sein de l'organisme hôte, ce qui les rend en outre résistants aux médicaments antiviraux.Les vaccins utilisés
à titre préventif.
Les vaccins peuvent être préparés en utilisant des virus vivants, des virus inactivés ou des sous-unités moléculaires du virus. (Les vaccins viraux inactivés et les sous-unités de virus sont tous deux incapables de provoquer la maladie). La pandémie de covid-19 a été l'occasion de mise au point par plusieurs laboratoires d'un tout nouveau type de vaccins à destination des humains, les vaccins à ARN messager. Les vaccins viraux
vivants sont conçus en laboratoire pour provoquer peu de symptômes
chez les receveurs, tout en leur conférant une immunité protectrice
contre les infections futures. La lutte contre la poliomyélite a
représenté une étape importante dans l'utilisation
des vaccins. Les campagnes massives de vaccination dans les années
1950 (vaccin inactivé) et 1960 (vaccin vivant) ont considérablement
réduit l'incidence de la maladie. Ce succès du vaccin contre
la polio a ouvert la voie à la dispensation systématique
de vaccins infantiles contre la rougeole, les oreillons, la rubéole,
la varicelle et d'autres maladies.
La vaccination a pour but de doper les défenses immunitaires de l'organisme pour que celui-ci soit mieux armé pour combattre l'infection virale. Les vaccins vivants sont généralement fabriqués en atténuant (affaiblissant) le virus «-de type sauvage-» (causant la maladie), en le cultivant en laboratoire dans des tissus ou à des températures qui diffèrent de ce à quoi le virus est habitué chez l'hôte. Les adaptations à ces nouvelles cellules ou températures induisent des mutations dans les génomes du virus, lui permettant de mieux se développer en laboratoire tout en inhibant sa capacité à provoquer des maladies lorsqu'il est réintroduit dans des conditions trouvées chez l'hôte. Ces virus atténués provoquent donc toujours une infection, mais ils ne se développent pas très bien, permettant à la réponse immunitaire de se développer à temps pour prévenir une maladie grave. Le problème de l'utilisation de vaccins vivants (qui sont généralement plus efficaces que les vaccins inactivés) est le risque faible mais significatif que ces virus reviennent à leur forme pathogène par des mutations inverses. Ces mutations se produisent lorsque le vaccin subit des mutations chez l'hôte de telle sorte qu'il se réadapte à l'hôte, pouvant à nouveau provoquer une maladie, qui peut ensuite se propager à d'autres humains lors d'une épidémie. Ce type de scénario s'est produit, par exemple, en 2007 au Nigéria, où des mutations dans un vaccin contre la polio ont conduit à une épidémie de cette maladie dans le pays. Les vaccins à ARN messager procèdent
d'une logique différente des autres vaccins. Ordinairement, l'ARN
messager (ARNm) est une molécule produite dans le noyau d'une cellule,
et qui est porteuse des informations nécessaires à la production
d'une protéine donnée ( Certains vaccins sont en développement continu car il existe des virus, tels que la grippe et le VIH, qui ont un taux de mutation élevé par rapport à celui d'autres virus et cellules hôtes normales. Dans le cas de la grippe, des mutations qui modifient les molécules de surface du virus empêchent l'organisme de bénéficier de l'immunité protectrice qui a pu être obtenue lors d'une saison grippale précédente, ce qui oblige les individus à se faire vacciner chaque année. D'autres virus, tels
que ceux qui causent les maladies infantiles, la rougeole, les oreillons
et la rubéole, mutent si rarement que le même vaccin est utilisé
année après année.
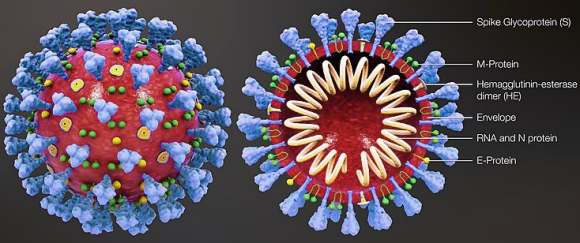
Le SARS-CoV-2, virus du covid-19, une maladie particulièrement contagieuse, identifiée à Wuhan en Chine, en novembre 2019, et qui a pris une dimension pandémique en moins de 3 mois. Sa gravité parfois, et sa mortalité dans un petit mais non négligeable nombre de cas, ajoutées à l'absence de traitement et de vaccin expliquent qu'elle ait eu un impact majeur et sans précédent sur l'économie et la vie sociale de toute la planète. modèle 3D : scientificanimations.com. Les vaccins et
les médicaments antiviraux utilisés pour le traitement.
Dans le cas de la rage, une maladie neurologique mortelle transmise par la salive des animaux infectés par le virus de la rage, la progression de la maladie depuis le moment de la morsure de l'animal jusqu'à son entrée dans le système nerveux central (temps d'incubation) peut durer de deux semaines à six semaines. C'est assez de temps pour vacciner les individus supposés avoir été mordus par un animal enragé, et permettre une réponse immunitaire renforcée, suffisante pour empêcher le virus de pénétrer dans les tissus nerveux. Ainsi, les conséquences neurologiques potentiellement mortelles de la maladie sont évitées. Cette approche a
commencé à être mise en oeuvre pour le traitement de
la fièvre ébola, provoquée par l'un des virus les
plus foudroyants et meurtriers que l'on connaisse. Transmise par les chauves-souris
et les grands singes, cette maladie peut provoquer la mort de 70 à
90% des Humains infectés en deux semaines. En utilisant de tout
nouveaux vaccins qui renforcent la réponse immunitaire de cette
manière, on espère que les personnes atteintes seront mieux
à même de contrôler le virus, ce qui pourrait sauver
d'une mort rapide et très douloureuse un plus grand pourcentage
de personnes infectées.

Le virus ebola. - Responsable d'épidémies de fièvres hémorragiques en Afrique centrale et en Afrique de l'Ouest, c'est un virus linéaire, à ARN monocaténaire, qui contient 19 000 nucléides, codant 8 protéines. (Crédits : images en microscopie à balayage, à gauche : Cynthia Goldsmith / CDC; et, à droite, en microscopie à transmission : Thomas W. Geisbert / Ecole de médecine de l'université de Boston). Les
traitements.
Dans le cas de la plupart des virus, ces médicaments peuvent inhiber le virus en bloquant les actions d'une ou plusieurs de ses protéines. Il est important de noter que les protéines ciblées doivent être codées par des gènes viraux et que ces molécules doivent être absentes de la cellule hôte saine. De cette façon, la croissance virale est inhibée sans endommager l'hôte. Des antiviraux particuliers ont été développés pour traiter l'herpès génital (herpès simplex II) et les grippes A et B. • Dans le cas de l'herpès génital, des médicaments tels que l'acyclovir peuvent réduire le nombre et la durée des épisodes de maladie active, au cours desquels les patients développent des lésions virales dans leurs cellules cutanées. Comme le virus reste latent dans les tissus nerveux du corps à vie, ce médicament n'est pas curatif mais peut rendre les symptômes de la maladie plus faciles à gérer. 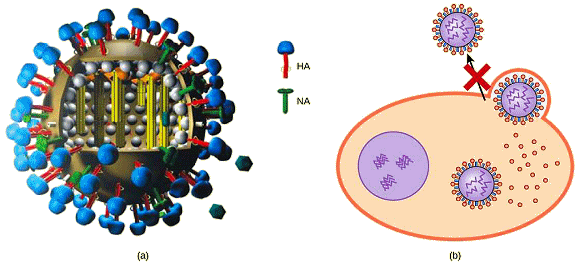
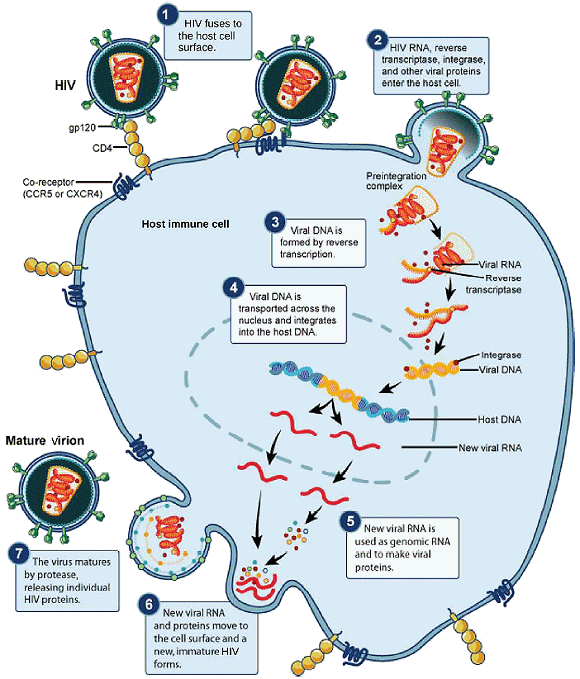
D'autres médicaments antiviraux, tels que la ribavirine, ont été utilisés pour traiter diverses infections virales, bien que son mécanisme d'action contre certains virus reste incertain. L'application la plus réussie - et de loin - d'un traitement basé sur des antiviraux concerne le rétrovirus VIH, à l'origine d'une maladie qui, si elle n'est pas traitée, est généralement mortelle dans les 10 à 12 ans après l'infection. Les médicaments anti-VIH peuvent contrôler la réplication virale au point que les individus recevant ces médicaments survivent beaucoup plus longtemps que les non traités. Les médicaments anti-VIH inhibent la réplication virale à plusieurs étapes du cycle de réplication du VIH (schéma ci-dessous) : des médicaments inhibent la fusion de l'enveloppe virale du VIH avec la membrane plasmique de la cellule hôte (inhibiteurs de fusion), d'autres la conversion de son génome ARN en ADN double brin (inhibiteurs de la transcriptase inverse, comme l'AZT), d'autres encore l'intégration de la l'ADN viral dans le génome hôte (inhibiteurs d'intégrase) et d'autre enfin le traitement des protéines virales (inhibiteurs de protéase). Malheureusement,
lorsque l'un de ces médicaments est utilisé individuellement,
le taux de mutation élevé du virus lui permet de développer
facilement et rapidement une résistance au médicament, ce
qui limite son efficacité. La percée dans le traitement du
VIH a été le développement de la multithérapie
antirétrovirale HAART, qui implique un mélange de différents
médicaments, parfois appelés « cocktail ». En
attaquant le virus à différents stades de son cycle réplicatif,
il est beaucoup plus difficile pour le virus de développer une résistance
à plusieurs médicaments en même temps. Cependant, même
avec l'utilisation de la thérapie combinée HAART, on craint
qu'avec le temps, le virus développe une résistance à
cette thérapie. Ainsi, de nouveaux médicaments anti-VIH sont
constamment développés dans l'espoir de continuer à
contrer ce virus hautement mortel.
Autres entités non-cellulaires : viroïdes et prionsViroïdes.Les viroïdes, que l'on divise en deux familles (les Pospiviroïdés et les Avsunviroïdés) sont des agents pathogènes des plantes (on ne connaît pas encore de maladie humaine ou animale causée par des viroïdes). Il s'agit de petites particules d'ARN circulaires monocaténaires qui sont beaucoup plus simples qu'un virus. Les viroïdes n'ont pas de capside ou d'enveloppe extérieure, mais de même que les virus, ils sont incapables de se reproduire autrement qu'à l'intérieur d'une cellule hôte. Contrairement aux virus, cependant, ils ne fabriquent aucune protéine et ils ne produisent qu'une seule molécule d'ARN spécifique. Les viroïdes sont responsables des mauvaises récoltes et de la perte importantes de revenus agricoles chaque année. Les pommes de terre, les concombres, les aubergines, les pêchers, les tomates, les chrysanthèmes, les avocatiers et les cocotiers figurent parmi les plantes qu'ils infectent. Prions.
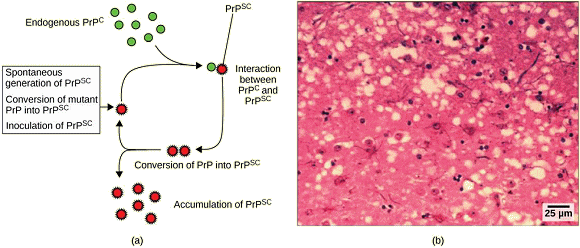
L'idée de l'existence d'agents infectieux n'utilisant pas d'acides nucléiques a tardé à être admise. Il a fallu attendre la fin des années 1970 et les travaux de Stanley Prusiner sur la tremblante du Mouton, puis, au milieu des années 1980, sur la maladie de Creutzfeldt-Jakob et diverses encéphalopathies spongiformes humaines et animales, pour que de telles entités s'imposent progressivement comme l'objet d'études. Parmi les maladies neurodégénératives fatales transmises par des prions, on peut mentionner le kuru (très proche de la maladie de Creutzfeldt-Jakob) chez l'Humain et l'encéphalopathie spongiforme bovine (ESB ou maladie de la vache folle) chez les Bovins, deux maladies dont on a montré qu'elles se sont propagées par la consommation de viande, de tissu nerveux ou d'organes internes par des représentants de la même espèce : consommation de chair humaine par les Humains et consommation de farines animales par les Bovins. • Le kuru, rencontré dans les années 1950 dans l'Est de la Papouasie-Nouvelle-Guinée, s'est propagé d'Humain à Humain via le cannibalisme rituel.Les individus atteints de kuru et d'ESB présentent des symptômes de perte de contrôle moteur et de comportements inhabituels (par exemple des éclats de rire incoercibles dans le cas du kuru), suivis de la mort. L'abandon du cannibalisme rituel, d'une part, et le renoncement à l'usage des farines animales pour l'alimentation du bétail, d'autre part, ont permis d'endiguer grandement la propagation de ces deux maladies. Les chercheurs ont d'abord cru que encéphalopathie spongiforme bovine ne touchait que les Bovins. Mais les lésions de leur tissu cérébral se sont avérées très similaires à celles causées par une encéphalopathie affectant les Humains, et connue sous le nom de variante de la maladie de Creutzfeldt-Jakob (MCJ). Il a pu être montré que cette nouvelle maladie pouvait être acquise en mangeant de la viande provenant d'animaux infectés par l'ESB. Cela a conduit divers pays à interdire l'importation de boeuf britannique et causant des dommages économiques considérables à la filière dans ce pays. L'ESB existe toujours dans certaines zones géographiques. Il s'agit désormais d'une maladie rare, mais toujours difficile à traiter. La maladie peut aussi se propager d'Humain à Humain par le sang, de sorte que de nombreux pays ont interdit le don de sang dans les régions associées à l'ESB. La cause des encéphalopathies spongiformes, telles que le kuru et l'ESB, est une variante structurelle infectieuse d'une protéine cellulaire normale appelée PrP (protéine prion). C'est cette variante qui constitue la particule nommée prion. La PrP existe sous
deux formes, la PrPc, la forme normale
de la protéine, et la PrPsc, la
forme infectieuse. Une fois introduit dans le corps, le PrPsc
contenu dans le prion se lie à la PrPc
et la convertit en PrPsc. Cela conduit
à une augmentation exponentielle de la protéine PrPsc,
qui s'agrège. La PrPsc est pliée
anormalement et la conformation (forme) qui en résulte est directement
responsable des lésions observées dans le cerveau des bovins
infectés. (D'après
des publications de la collection Openstax
de l'Université Rice).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
| . |
|
|
|
|||||||||||||||||||||||||||||||
|